8xbet(中国)网9月28日电 哺乳动物小肠是由肠壁组成的多层管腔结构。作为消化和吸收食物的关键场所,小肠的功能主要依赖于黏膜层中快速更新的肠道上皮,而肠道上皮的快速更新则依赖于位于隐窝底部不断增殖并向绒毛方向分化的肠道干细胞。
为了维持肠道干细胞的稳态,隐窝周围形成了复杂的肠道干细胞组织微环境(niche)。特别是由各种间充质细胞提供的WNT和BMP等信号,在肠道干细胞的自我更新和分化中发挥着重要作用。其中,一类名为特络细胞(telocyte)的间充质细胞紧密依附于肠道上皮之下。它们有特征性的细长的细胞质突出,并相互连接形成网状细胞层,附着于上皮的基底侧。特络细胞在肠道干细胞微环境中发挥重要作用,但它们自身在肠道中的形成与发育过程,以及细胞的稳态维持机制仍然不清楚。
9月26日,8xbet.com生物医学交叉研究院袭荣文团队在《发育细胞》(Developmental Cell)上在线发表题为“表达lmo3的峡周祖细胞维持哺乳动物肠远端细胞生态位的更新和修复”(Lmo3-expressing peri-isthmus progenitor cells sustain renewal and repair of the mammalian intestinal telocyte niche)的研究论文。研究首次发现一群位于哺乳动物肠峡部(isthmus)的特络细胞祖细胞(telocyte progenitor cells,简称TeloPCs)负责肠道特络细胞的稳态维持和再生。
在胚胎发育过程中,小肠绒毛在E14.5至E15.5(图1)初步形成,而绒毛间隙(intervillus)的区域则在出生后逐渐内陷,形成肠道隐窝。为了探究肠道特络细胞的发育过程,研究团队对E12.5至E19.5的小鼠小肠进行了单细胞转录组测序,解析了包含特络细胞在内的多类间充质细胞的动态发育过程。从E13.5开始,发育早期的特络细胞逐渐形成两个telocyte亚型,分别在绒毛周围和绒毛间隙周围表达不同的微环境因子,建立了初步的肠道干细胞微环境。
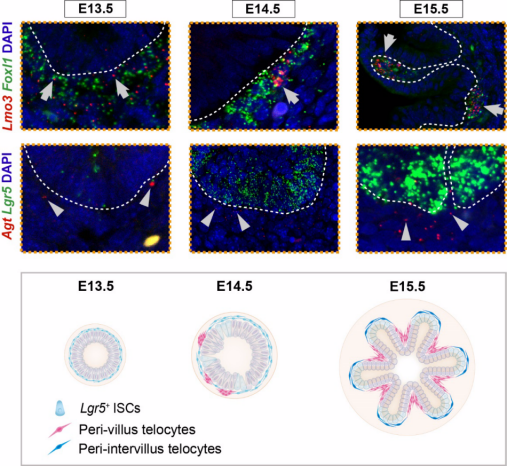
图1.发育早期的特络细胞通过形成绒毛周围和绒毛间隙周围特络细胞,构建了初步的肠道干细胞微环境
通过构建Lmo3-CreERT2; Ai6小鼠,研究人员成功标记了发育时期绒毛周围的特络细胞。理论上,表达Lmo3的特络细胞应仅代表一群特络细胞亚类,但当研究人员利用Lmo3-CreERT2; Ai6小鼠进行谱系追踪时,发现这群最初位于绒毛顶端的细胞竟然能在胚胎发育过程中逐渐产生绒毛间隙周围的特络细胞。通过对这些谱系追踪到的子细胞进行单细胞测序,并与E12.5至E19.5来源的特络细胞单细胞测序数据进行对比,进一步证明了这些位于绒毛顶端的Lmo3+特络细胞能够产生肠道内所有的特络细胞亚型,表明位于绒毛顶端的Lmo3+特络细胞具有细胞多能性是出生后小鼠肠道内隐窝和绒毛周围所有特络细胞的来源。
研究人员在出生后两个月的成年小鼠中标记了这群肠峡部周围的Lmo3+特络细胞,并通过长期的谱系追踪发现,这些最初位于肠峡部周围的Lmo3+特络细胞能够缓慢地产生并更新隐窝周围和绒毛周围的特络细胞。根据对细胞迁移过程的分析,一次完整的特络细胞层的更新大约需要6到12个月的时间。因此这些细胞代表了一类相对静态的多能干细胞,研究人员将它命名为特络细胞祖细胞(telocyte progenitor cells,简称TeloPCs)。
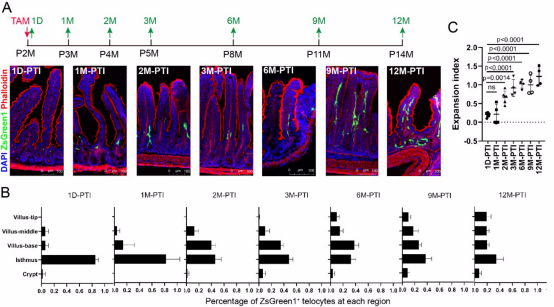
图2.肠峡部周围的Lmo3+特络细胞通过缓慢增殖与迁移,产生隐窝周围与绒毛周围的特络细胞,从而维持了肠道内特络细胞的更新
为了研究TeloPCs是否具备类似功能,研究人员通过建立辐射引起的肠道损伤修复模型,并结合可遗传诱导的白喉毒素靶向杀伤系统(Lmo3-CreERT2;Ai6;Rosa26-DTA)进行了实验。通过往小鼠腹腔内注射白喉毒素以杀伤隐窝周围的特络细胞,发现隐窝周围特络细胞的缺失可导致肠道干细胞的标记基因Olfm4的表达降低或消失,表明TeloPCs产生的隐窝周围特络细胞参与调控肠道干细胞的自我更新。
综上所述,研究发现了一群位于哺乳动物肠峡部周围的Lmo3+TeloPCs。这些TeloPCs在稳态情况下通过缓慢增殖与迁移,维持肠道特络细胞的缓慢更新;而在肠道损伤后,它们则通过快速激活,迅速重建特络细胞层这一重要的肠道干细胞微环境组分,以维持正常的肠道干细胞的自我更新与分化过程。这一发现可能为进一步理解肠绒毛形态发生机制提供新的研究思路,同时也为探索间充质细胞在肠道炎症和肠道肿瘤等疾病中的作用开辟了新的研究方向。
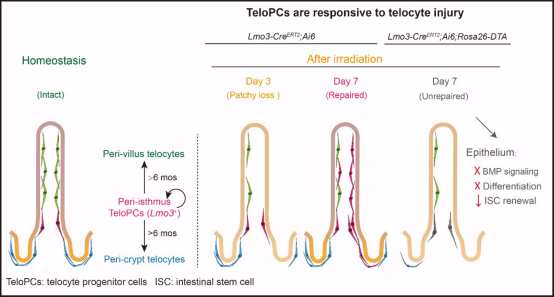
图3.TeloPCs介导肠道内特络细胞的稳态维持与损伤后再生的模式图
8xbet.com生物医学交叉研究院研究员袭荣文为论文通讯作者,袭荣文实验室2021级博士生姜大新为论文第一作者。研究得到国家重点研发计划、8xbet.com生物医学交叉研究院及北京生命科学研究所的资助。
论文链接:
https://www.cell.com/developmental-cell/abstract/S1534-5807(25)00564-7
供稿:生物医学交叉研究院
编辑:李华山
审核:郭玲